Zur Integrität des Gesamtkohlenstoffs (TOC) in unsterilen Wasserproben
Von Anja Paul, Arno Bayerl und Wolfgang Woiwode
Schlüsselwörter: Reinigungsvalidierung, Wasserproben, Pseudomonas aeruginosa, Candida albicans, Transportvalidierung, Gesamtkohlenstoff, TOC-Bestimmung, Wischen, Spülen
Key words: Cleaning validation, aqueous samples, Pseudomonas aeruginosa, Candida albicans, transport validation, Total Organic Carbon, TOC-determination, swab, rinse
Die Probenahme durch Spülen und Wischen mit Wasser im Zusammenhang mit der Reinigungsvalidierung mit dem Ziel der Gesamtkohlenstoffbestimmung (Total Organic Carbon, TOC) wird überwiegend unsteril vorgenommen. Sofern nicht spezielle Vorkehrungen getroffen werden, wie z.B. Sterilisation der Probengefäße und der Probenbestecke, sind die zu beprobenden Oberflächen, das Medium Wasser, die Probengefäße, die Probenbestecke, die Umgebungsluft und das Personal mikrobiologisch potentiell kontaminiert. Die Proben können daher eine zunächst nach Art und Anzahl nicht bekannte Belastung durch Mikroorganismen als Startfracht enthalten. Falls dennoch eine orientierende Gesamtkeimzahlbestimmung durchzuführen ist, sollte die mikrobiologische Bestimmung mittels Membranfiltration, Ausspatelmethode, oder Plattengussverfahren nach temperaturkontrolliertem Transport kurzfristig durchgeführt werden, damit das Keimwachstum nach Probenahme minimiert wird. Im Fall der Gesamtkohlenstoffbestimmung ist es andererseits häufig sinnvoll, Proben z.B. aus einer Kampagne zu sammeln, und erst dann dem Untersuchungslabor z.B. per Kurier zu überstellen. Der Gesamtkohlenstoff einer Probe repräsentiert dabei eine für Mikroorganismen nutzbare Kohlenstoffquelle. Der Abbau organischer Verbindungen und Metabolisierung bedingt durch Keimbelastung und Keimwachstum sind daher nicht auszuschließen, die Transportkette ist diesbezüglich zu validieren. Seitens TECHPharm GmbH haben wir bereits in der Vergangenheit zeigen können, dass ein Kohlenstoffgehalt wässriger Saccharoselösungen von 500 ppb über mehr als 14 Tage bei 25 °C unverändert bleibt [1]. Dieser Beitrag zur Transportvalidierung ist jedoch nur indirekt, da der mikrobiologische Status dieser Proben nicht parallel untersucht wurde. Unser Ziel war es daher, über das nachfolgend skizzierte Versuchsdesign einen weiteren Beitrag zur Integrität des Gesamtkohlenstoffs (TOC) in unsterilen Wasserproben zu leisten. Das Design war wie folgt:
Theoretische Betrachtung des Kohlenstoffeintrags bzw. des Kohlenstoffbedarfs durch eine Keimfracht
Experimentelle Überprüfung der Gesamtkeimzahl, bzw. des Keimwachstums und des Kohlenstoffgehalts in Abhängigkeit von der Zeit
Untersuchung der Gesamtkeimzahl und des Gesamtkohlenstoffs in einer vorgelegten Keimsuspension und nach zeitabhängigem Keimwachstum mit N=7
Über die Ergebnisse berichten wir nachfolgend.
1. Theoretische Betrachtung des Kohlenstoffeintrags bzw. des Kohlenstoffbedarfs durch eine Keimfracht
Gesamtkeimzahlen um 1.000 KBE/mL, 10.000 KBE/mL und 100.000 KBE/mL werden orientiert an der Trinkwasserverordnung gemeinhin als hoch erachtet. Da nachfolgend noch weitere große Zahlen behandelt werden, verwenden wir hier den Punkt als Tausender-Trennzeichen. Wir haben jetzt zunächst das Volumen von hier angenommen kugelförmigen Mikroorganismen mit einem Durchmesser von 2 µm für die genannten Keimbelastungen nach der Formel V=4/3 * π * r3 berechnet:
| d [µm] | r [µm] | V [µm3] | 1.000 KBE/mL | 10.000 KBE/mL | 100.000 KBE/mL |
| V [µm3] | V [µm3] | V [µm3] | |||
| 2 | 1 | 4,189 | 4,189 | 41.888 | 418.879 |
Nach erster Recherche gibt es eher wenige gesicherte Angaben zur Biomasse, noch genauer: zum Kohlenstoffgehalt mehrheitlich der bekannten Mikroorganismen. Einer diesbezüglichen Arbeit [2] haben wir einen Umrechnungsfaktor von 0,22 g C/cm3 (Kohlenstoffmasse/Biovolumen) entnommen. Die Lösung der Rechenaufgabe
0,22 [g] / 1.000 mm3 = x [g] / 418.879 µm3
für das Beispiel 100.000 KBE/mL mit der Umrechnung
1.000 mm3 = 1.000.000.000.000 µm3
liefert das Ergebnis 0,000 000 092 g C/ cm3. Mit der weiteren Vereinfachung 1 g = 1 mL resultiert für eine Keimbelastung von 100.000 KBE/mL eine Kohlenstofffracht von 92 ppb. Ein Keimwachstum auf 100.000 KBE/mL erfordert demnach zunächst einmal 92 ng Kohlenstoff (aus 1 mL), der in Biomasse umgewandelt wird. Damit sollte der C-Gehalt der Lösung zunächst konstant bleiben, bevor z.B. durch Hefen und Pilze eventuell Katabolisierung weiteren Kohlenstoffs in Kohlendioxid stattfinden kann. Der im Kohlendioxid gebundene Kohlenstoff würde der Gesamtbilanz erst im Verlauf der TOC-Bestimmung entnommen werden, da CO2 vor der Messung des TOC ausgetrieben wird. Dieser theoretischen Betrachtung folgend sollte ein Keimwachstum auf z.B. 10.000 100.000 KBE/mL ohne Auswirkung auf die Kohlenstoffbilanz im interessierenden Bereich von etwa 500 ppb 5.000 ppb bleiben.
2. Experimentelle Überprüfung der Gesamtkeimzahl, bzw. des Keimwachstums und Kohlenstoffgehalt in Abhängigkeit von der Zeit
Für die Überprüfung des Keimwachstums und des Kohlenstoffgehalts über die Zeit wurde als Modellorganismus das gram-negative Bakterium Pseudomonas aeruginosa, ein typischer Wasserkeim ausgewählt. Pseudomonas aeruginosa ist anspruchslos, laut Literatur unempfindlich gegen verdünnte Reinigungsmittel, wächst in gereinigtem Wasser und bildet Biofilme. In einer Medienflasche mit 2 L Nennvolumen wurde als Nährmedium Saccharoselösung mit 250 ppb TOC vorgelegt und mit einer Bakteriensuspension auf eine berechnete Konzentration von 50 KBE/mL im Endvolumen 2 L angeimpft. Diese Suspension wurde bei 30 °C inkubiert. Zu den in der nachfolgenden Tabelle ausgewiesenen Terminen nach jeweils ganzen Tagen wurden 50 mL entnommen und der TOC der Kultur und die Gesamtkeimzahl bestimmt.
Tabelle 1 und Abbildung 1: Pseudomonas aeruginosa, KBE/mL und TOC in Abhängigkeit von der Zeit
| Tage | 0 | 1 | 3 | 7 | 10 | 11 |
| KBE/mL | 504 | 20.000 | ./. | 470.000 | 1.560.000 | 2.760.000 |
| TOC, ppb | 600 | 937 | 379 | 460 | 383 | 614 |
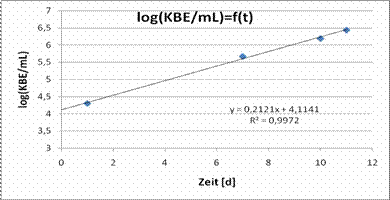
Die Ergebnisse belegen exponentielles Wachstum der Bakterienkultur auf zuletzt 2.760.000 KBE/mL nach 11 Tagen. Der TOC der Lösung verblieb dabei praktisch unverändert konstant.
3. Untersuchung der Gesamtkeimzahl und des Gesamtkohlenstoffs mit N=7 in einer vorgelegten Keimsuspension und nach zeitabhängigem Keimwachstum über 11 Tage
In der weiteren experimentellen Bearbeitung war jetzt zu prüfen, ob die unter 2. für ein Bakterium geschilderten Findungen auch für den Hefepilz Candida albicans gilt, und weiterhin, ob die Ergebnisse im Rahmen der biologischen und messtechnisch bedingten Bandbreite präzise sind. Dafür wurde als Nährmedium Saccharoselösung mit 250 ppb TOC vorgelegt und mit einer Keimsuspension auf eine berechnete Konzentration von 50 KBE/mL im Endvolumen eingestellt. Diese Kultur wurde strichvoll in 7 Medienflaschen mit dem Nennvolumen 100 mL umgefüllt, die anschließend bei 30 °C inkubiert wurden. Nach 7 Tagen wurden der TOC der Kultur und die Gesamtkeimzahl mit N=7 bestimmt:
Tabelle 2: Candida albicans, KBE/mL und TOC nach 11 Tagen,
| Startwert | Nach 7 Tagen, Flasche Nr. | ||||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | Mittelwert | |
| Toc, ppb | 391 | 498 | 545 | 775 | 593 | 616 | 567 | 625 | 603 |
| KBE/mL | 50 1) | 146.000 | 116.000 | 72.000 | 101.000 | 70.000 | 80.000 | 114.000 | 99.857 |
1) berechnet
Die Ergebnisse belegen, dass auch im Fall des Hefepilzes Candida albicans der TOC der Lösung auch bei Keimwachstum auf rund 100.000 KBE/mL konstant bleibt.
Zusammenfassung
Die theoretische Betrachtung zeigt, dass ein Wachstum typischer Keime mit Durchmesser um 2 µm auf Werte um 100.000 KBE/mL die Kohlenstoffbilanz der Trägerlösung nicht verändert. Dies ist bedingt einerseits durch die unvorstellbar geringen Konzentrationen, und weiterhin dadurch, dass mobiler organischer Kohlenstoff voraussichtlich zunächst nur in die Zellen umgebaut wird. Die beiden geschilderten experimentellen Überprüfungen haben diese Zusammenhänge im vollen Umfang bestätigt. Als Konsequenz ist mögliches mikrobiologisches Wachstum in Wasserproben aus der Reinigungsvalidierung hinsichtlich der TOC-Bestimmung unkritisch. Die Kühlung von Proben im Verlauf der Transportkette, die aus logistischer und ökonomischer Sicht höhere Anforderungen stellt, kann entfallen. Auf Zwischenlagerung im Kühlschrank sollte im Gegenteil verzichtet werden, weil Kühlschränke mit kühlen, feuchten und organikhaltigen Dämpfen die Probengefäße aus der Reinigungsvalididerung äußerlich kontaminieren, was ein Kontaminationsrisiko für die Entnahme darstellt. Insgesamt haben wir damit unsere vorausgegangenen Empfehlungen zur Probenahme für die TOC-Bestimmung in der Reinigungsvalidierung und unsere vorausgegangenen experimentellen Findungen an Saccharoselösungen mit 500 ppb TOC [1] bestätigt. Die Integrität des Gesamtkohlenstoffs ist auch bei Keimwachstum auf z.B. 2.500.000 KBE/mL über z.B. 10 Tage gesichert und damit zunächst unabhängig von metabolischen und katabolischen mikrobiologischen Vorgängen. „Integrität“ wird in diesem Zusammenhang so verstanden, dass weder eine Abnahme, noch eine Zunahme erfolgt. Im Umkehrschluss kann eine mikrobiologische Belastung von gereinigtem Wasser mit Werten von z.B. 10.000 KBE/mL bis 100.000 KBE/mL bei einer Ergebnislage unterhalb des Grenzwerts „max. 0,5 ppm“ nicht über den TOC detektiert werden.
Literatur
1. TECHPharm GmbH, TOC-Bestimmungen an Saccharoselösungen mit 500 ppb TOC nach Lagerung bei 5 °C ± 3 °C, 25 °C ± 2 °C und 40 °C ± 2 °C, unveröffentlichte Ergebnisse
2. Bacterial Dry Matter content and Biomass Estimations, Gunnar Bratbak und Ian Dundas, Applied and Environmental Microbiology, 10/1984, S. 755-757

